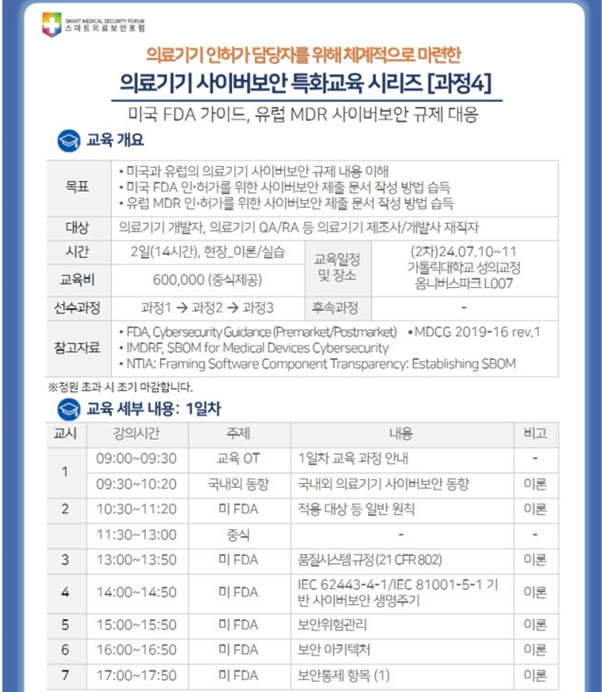
(출처: 한국의료기기산업협회) 스마트의료보안포럼에서는 미국과 유럽의 의료기기 사이버보안 규제 내용을 이해하고 미국 FDA, 유럽 MDR 인허가를 위한 사이버보안 제출 문서 작성 방법 습득을 위해’미FDA, 유럽 MDR 사이버보안 규제 대응’ 교육을 진행하오니 많은 관심과 참여 바랍니다. ○ 교육일시 : 2024년 7월 10일(수) ~ 11일(목) ○ 교육장소 : 가톨릭대학교 성의교정 옴니버스 파크 L007 ○ 교육주최 : 스마트의료보안포럼 ○ 교육내용 - 미국과 유럽의 의료기기 사이버보안 규제 내용을 이해 - 미국 FDA 인허가를 위한 사이버보안 제출 문서 작성 방법 습득 - 유럽 MDR 인허가를 위한 사이버보안 제출 문서 작성 방법 습득 ○ 교육비용 : 600,000원 ○ 참석대상 : 의료기기..