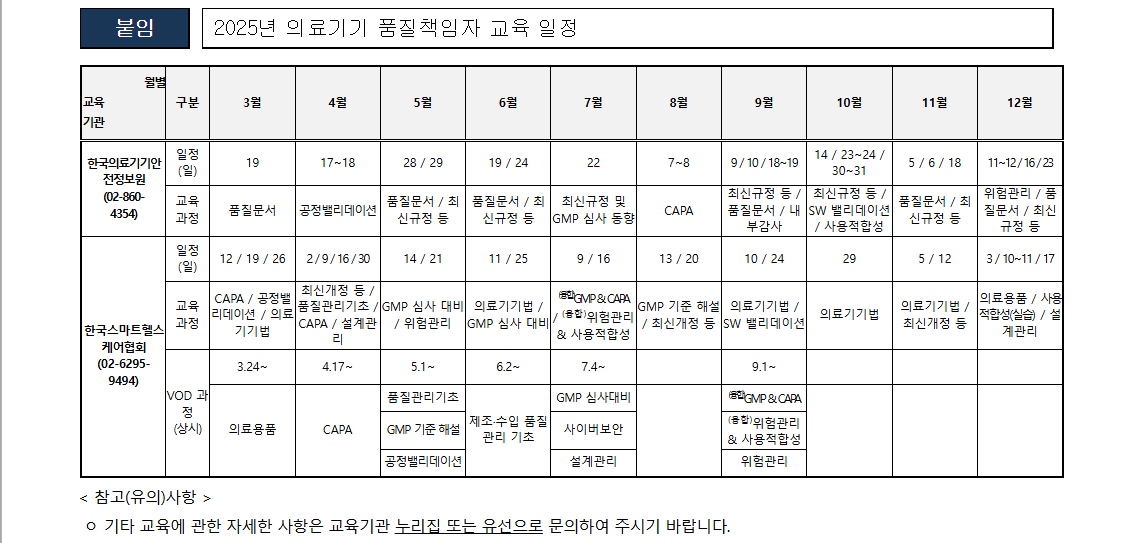
In November 2022, the Swiss Federal Assembly voted to approve Motion 20.3211 (link in French), which mandated the Swiss Federal Council to adopt regulations to allow medical devices authorized by non-European regulators — namely, the United States (U.S.) Food and Drug Administration (FDA) — to enter the Swiss market. At its meeting on April 30, 2025, the Federal Council defined guidelines for im..