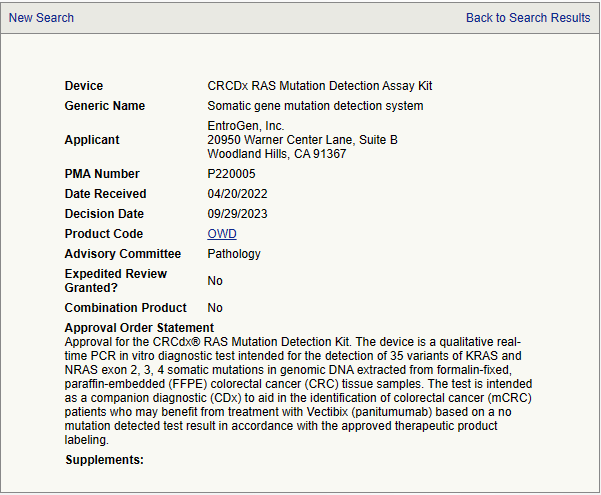
This guidance document provides Food and Drug Administration’s (FDA’s or the Agency’s) recommendations on testing to assess the safety and compatibility of medical devices in the Magnetic Resonance (MR) Environment and the recommended format for Magnetic Resonance Imaging (MRI) Safety Information in medical device labeling. This guidance applies to all medical devices that might be used in the M..