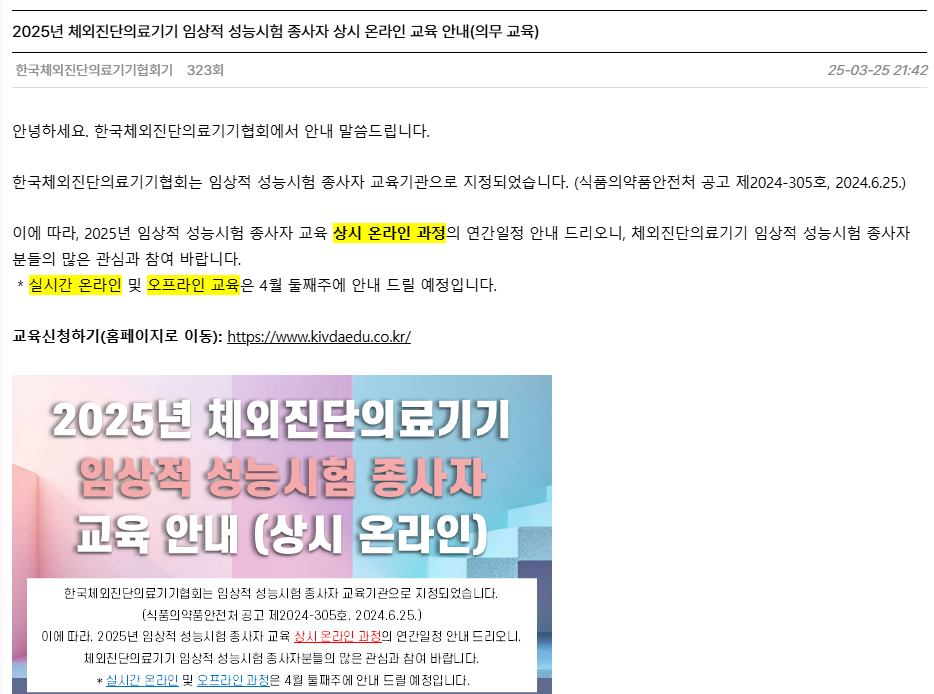
한국체외진단의료기기협회가 임상적성능시험 종사자 교육기간으로 지정되어, 상시 온라인과정을 개설하였다. ▶ 교육명- 심사자(IRB), 모니터요원, 시험책임자 및 담당자 각 과정의 기본 / 전문(1)- 보수과정, 임상적 성능시험 통계기법 ▶ 교육기간2025년 03월 26일 ~ 12월 12일(금)까지 ▶ 교육목표임상적 성능시험기관 종사자 역량강화를 통한 체외진단의료기기의 안전성 확보 및 품질향상 ▶ 접수기간2025년 03월 26일 ~ 12월 12일(금) ▶ 모집인원제한없음 ▶ 교육비무료 (2025년) ▶ 교육대상체외진단의료기기 임상적 성능시험 종사자 2025년 체외진단의료기기 임상적 성능시험 종사자 상시 온라인 교육 안내(의무 교육) > 공지사항 | 한국체외진단의료기기협회 KIVDA 한국체외진단의료기기협회식품..