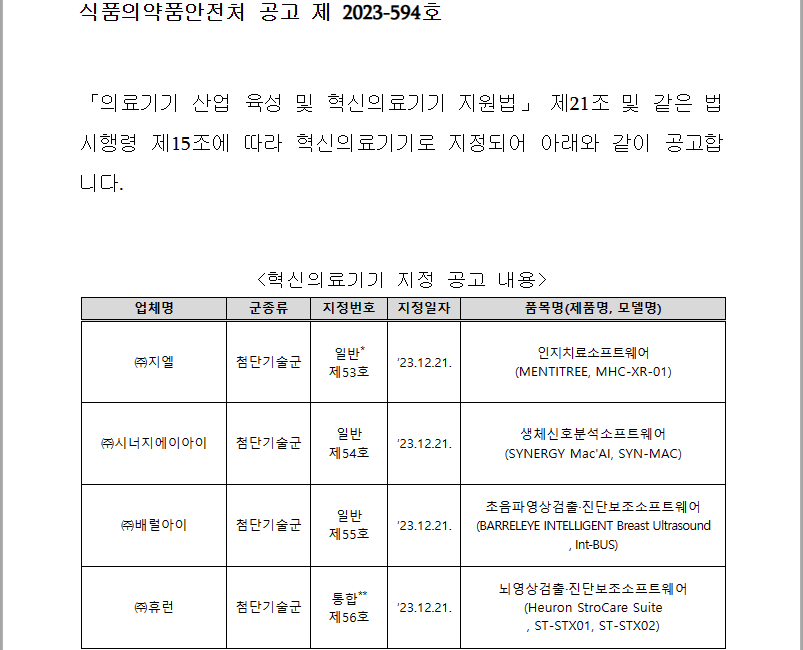
▶ 식품의약품안전처에서 아래와 같이 혁신의료기기 지정결과를 공고함 ▶ 혁신의료기기 지정 공고 내용 1. (주)지엘 (일반 제53호): 첨단기술군 - 품목군: 인지치료소프트웨어 - 제품명/모델명: MENTITREE / MHC-XR-01 2. (주)시너지에이아이 (일반 제54호): 첨단기술군 - 품목군: 생체신호분석소프트웨어 - 제품명/모델명: SYNERGY Mac'AI / SYN-MAC 3. (주)배럴아이 (일반 제55호): 첨단기술군 - 품목군: 초음파영상검출, 진단보조소프트웨어 - 제품명/모델명: BARRELEYE INTELLIGENT Breast Ultrasound / Int-BUS 4. (주)휴런 (통합 제56호): 첨단기술군 - 품목군: 뇌영상검출진단보조소프트웨어 - 제품명/모델명: Heuron ..