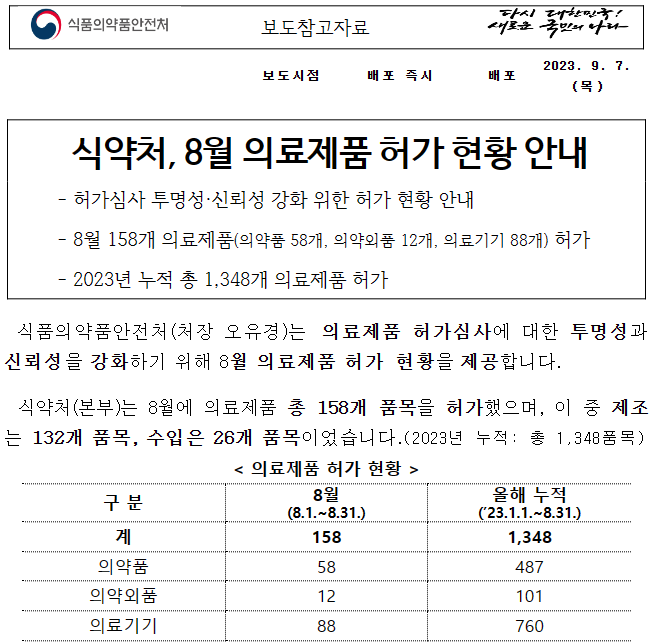
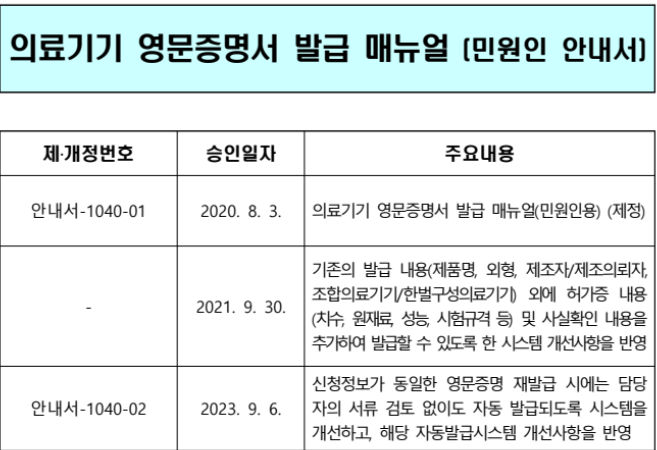
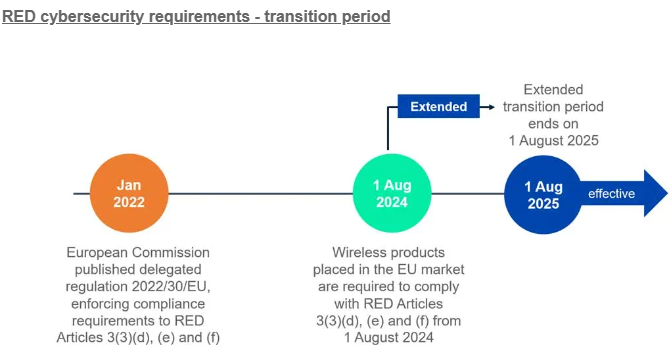
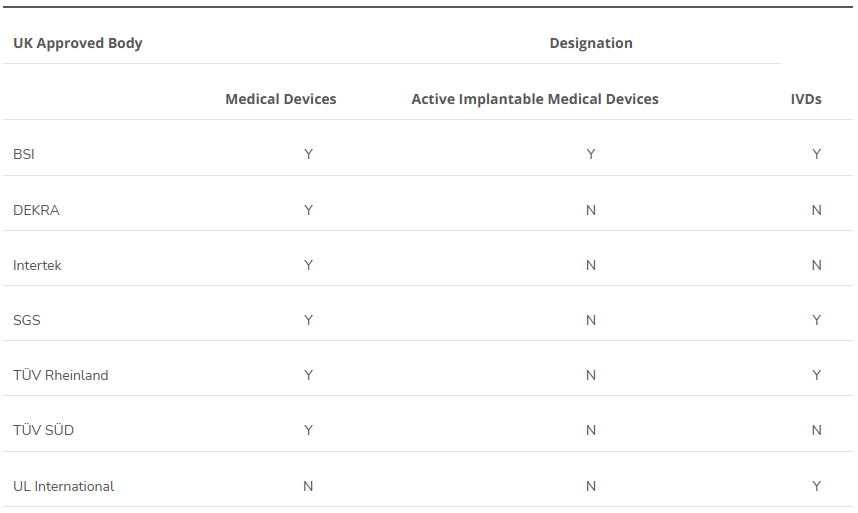
Emergo by UL에서 EU MDR 관련 웨비나 예정 일자: 2023년 09월 26일 오전 9시~10시 (CDT, 한국시간 저녁 11시~12시) 주제: EU MDR PMS including PMCF and Vigilance EU MDR PMS Including PMCF and Vigilance | Emergo by UL EU MDR PMS Including PMCF and Vigilance In this complimentary webinar, our Emergo by UL subject matter expert will outline the latest insights about EU MDR PMS, including PMCF and vigilance. www.emergobyul.com