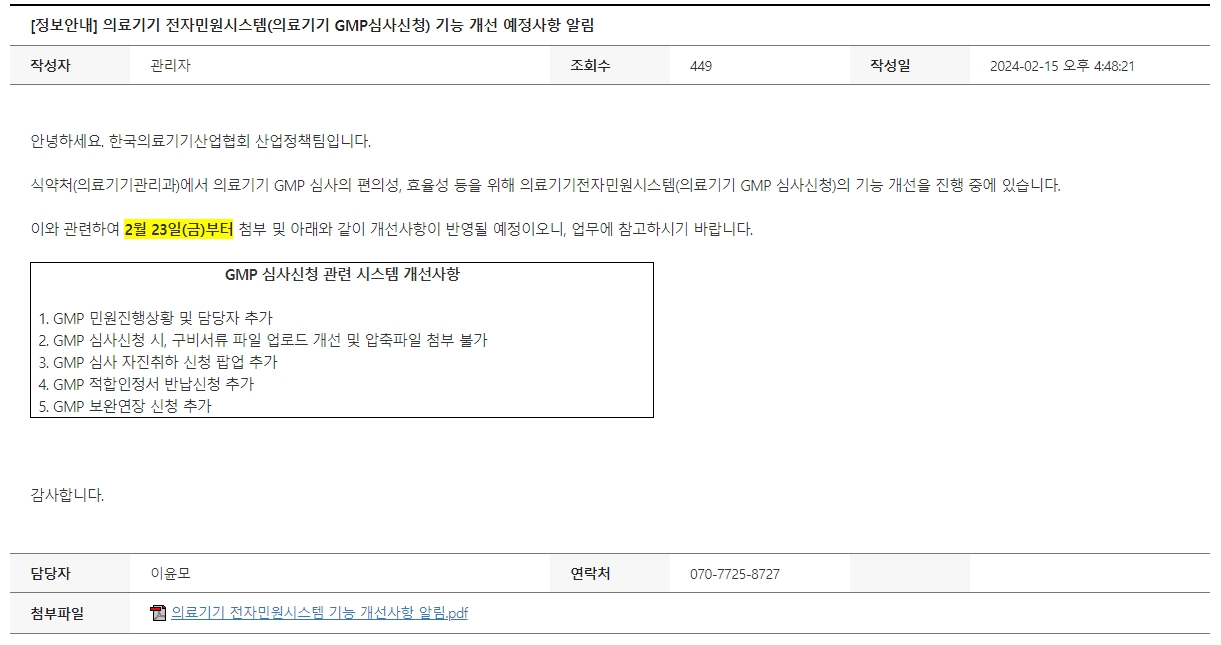
In Vitro Diagnostic (IVD) devices are a critical component of healthcare, as they help users diagnose conditions and formulate an appropriate treatment plan for a patient. In some cases, they may also be used for care management for certain diseases. In the U.S., IVDs are regulated like other medical devices and divided into one of three classes, each with its own general expectations for a spec..