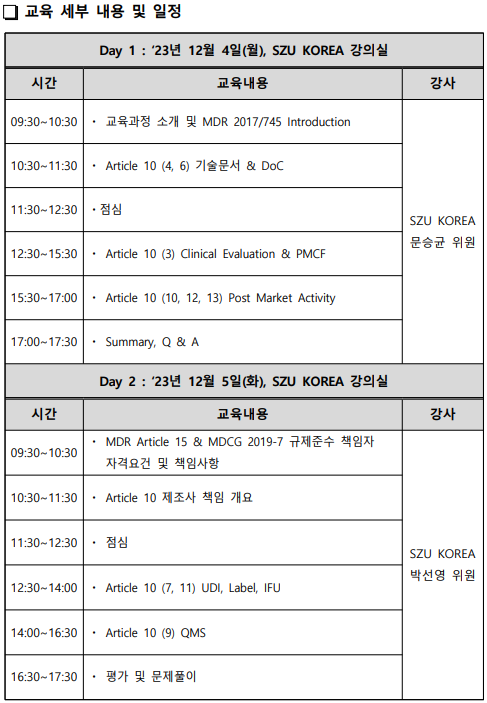
▶ Introduction The Regulation (EU) 2017/745 on medical devices, hereafter referred to as the MDR (medical device regulation), provides a possibility to use clinical data related to an equivalent device in the clinical evaluation required for a device under conformity assessment. Whilst carrying out a clinical investigation is the most direct way to generate clinical data concerning the safety an..