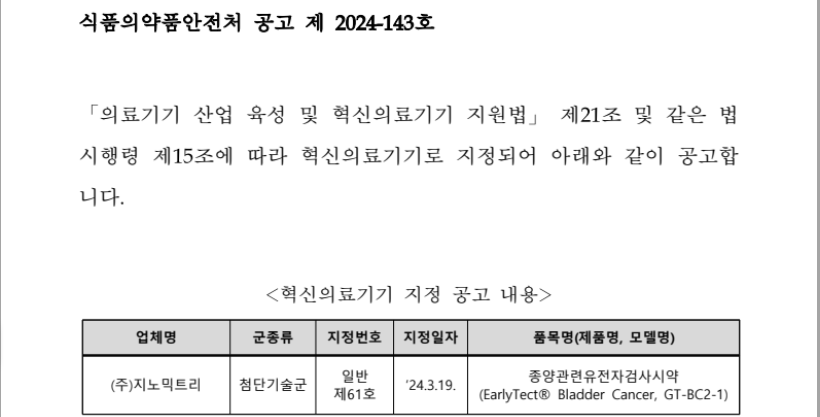
▶ 식품의약품안전처에서 아래와 같이 혁신의료기기 지정결과를 공고함 ▶ 혁신의료기기 지정 공고 내용 1. (주)뉴냅스 (통합 일반 제33호): 첨단기술군 - 품목군: 인지치료소프트웨어 - 제품명/모델명: VIVID Brain / NNS-VB 식품의약품안전처>알림>공지/공고>공고 - 상세보기 | 식품의약품안전처 (mfds.go.kr) 식품의약품안전처>알림>공지/공고>공고 | 식품의약품안전처 혁신의료기기 지정 공고(통합-일반 제33호) 식품의약품안전처 공고 제 2024-175호 ‘24년 제2차 혁신의료기기 통합심사·평가와 관련하여 혁신의료기기 지정과 동시에 요양급여대상 또는 비급여대 www.mfds.go.kr